Circulation Research | 蔡卫斌团队揭示糖尿病心肌损伤中代谢-结构病理联接新机制
中国糖尿病患病人数高达 1.48亿,已成为严重威胁国民健康的重大公共卫生问题,给“健康中国 2030”战略带来了严峻挑战。胰岛素的临床应用和新型治疗手段的出现使糖尿病病人寿命延长,原本隐匿或晚发的糖尿病心肌损伤“从幕后走到前台”,已成为糖尿病患者死亡的重要风险因素。脂代谢紊乱和心肌结构异常是糖尿病心肌损伤的两大典型病理特征,但化学代谢紊乱如何导致物理结构异常、代谢与结构相互偶联并协同促进糖尿病心脏功能障碍的机制尚未阐明。系统解析代谢-结构病理性联接的作用模式与分子机制,有望为糖尿病心肌病精准治疗提供新策略和干预新靶点,为全球糖尿病患者的心血管保护提供中国智慧。
2025年4月7日,博彩公司排名-博彩公司评级 、中山大学实验动物中心蔡卫斌教授团队与中山大学孙逸仙纪念医院生殖医学中心陈慧教授团队合作在知名期刊Circulation Research上发表了题为Metabolic Coordination Structures Contribute to Diabetic Myocardial Dysfunction的研究论文。该研究利用代谢流与组学分析、三维透射电镜等技术观察了ACBP通过结合肌小节关键结构蛋白MyBPC3阻抑心肌收缩装置,从代谢-结构病理联接角度阐释糖尿病心肌损伤新机制。
该团队通过多维度研究体系发现伴有心脏收缩和舒张功能障碍的糖尿病小鼠心脏表现出增强的脂质代谢和受损的超微结构。作者通过分析4个2型糖尿病(T2DM)心肌转录组公共数据集,发现酰基辅酶A结合蛋白(ACBP)是糖尿病心肌中上调的重要脂代谢基因。团队构建了心肌细胞特异性敲除ACBP小鼠(α-MyHC-Cre:Acbpflox/flox小鼠),表现出T2DM诱导的心脏重塑和心功能障碍的减轻。进一步利用13C标记的葡萄糖和棕榈酸进行了同位素标记的代谢流示踪分析,α-MyHC-Cre:Acbpflox/flox小鼠心脏中葡萄糖氧化增强而脂肪酸利用减少,ACBP缺失使糖尿病心肌代谢重编程和代谢补偿改善心肌能量供应。为了进一步探究代谢和结构耦联的分子基础,团队通过Co-IP联合质谱技术发现ACBP与心肌骨架结构蛋白MyBPC3直接结合,高分辨率透射电镜三维重构显示,ACBP-MyBPC3相互作用阻碍了横桥结构的形成,导致粗/细肌丝交联结构减少,抑制心肌收缩。同时ChIP-seq和Luciferase Assay证实,PPARγ-ACBP轴是糖尿病心肌代谢-结构偶联的关键调控通路。
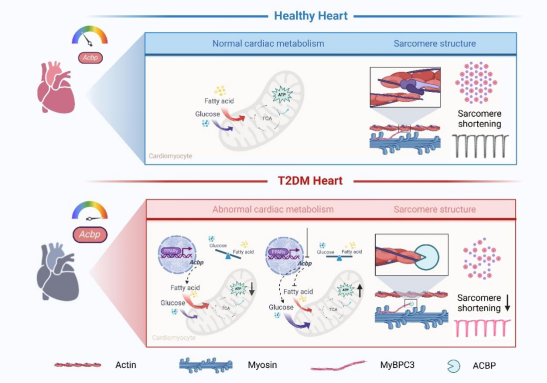
本研究首次提出“代谢-结构偶联”是糖尿病心肌病的重要发病机制,糖尿病状态下ACBP可作为同时改善心肌代谢和结构异常的双效靶点,靶向干预ACBP可同步实现心肌代谢重塑(恢复底物代谢灵活性)和结构修复(解除ACBP-MyBPC3病理互作),有望成为改善DCM的潜在治疗靶点。
博彩公司排名-博彩公司评级 蔡卫斌教授、谭静副研究员和中山大学孙逸仙纪念医院生殖医学中心陈慧教授为论文的共同通讯作者。博彩公司排名-博彩公司评级 2020级博士吴腾(现为孙逸仙纪念医院博士后)和2019级博士黄统生为共同第一作者。中山大学实验动物中心/广东省疾病模式动物工程技术研究中心、博彩公司排名 代谢组平台黄蓬教授团队、生命科学学院电镜平台张勤奋副教授团队、博彩公司排名 科研仪器平台等为本研究提供重要技术支撑。
原文链接:
//www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.326044



